Maddenin Tanecikli Yapısı Konu Anlatımı 7.Sınıf, her sene karşımıza çıkabilecek bir konu olduğundan bu konu anlatımını çok iyi bilmemiz gerekmektedir. Maddenin Tanecikli Yapısı Konu Anlatımı soruları daha kolay bir şekilde çözebilmeniz için size yardımcı olacak Maddenin Tanecikli Yapısı Konu Anlatımını bu yazımızda anlatıyoruz. Maddenin Tanecikli Yapısı ile ilgili bilmemiz gereken konu içeriğini şu şekilde sıralayabiliriz:
Atomun Yapısı – Bağlı Atom
Çevremizdeki bütün maddeler atomlardan oluşmaktadır. Maddeleri oluşturan bu atomlar moleküller hâlinde ve birbirine yakın hâlde bulunur. Birbiri ile temas hâlinde olan ve molekülleri oluşturan atomlara ise bağlı atom adı verilir.
Atomu Oluşturan Tanecikler
» Bir cam çubuk, ipek kumaşa sürtüldükten sonra kâğıt parçalarına yaklaştırıldığında çubuğun, kâğıt parçalarını çektiği görülür. Bu durum elektriksel çekim kuvveti ile açıklanabilir.
Başlangıçta her ikisi de yüksüz olan cam çubuk ve ipek kumaş, sürtme sırasında elektriksel yük kazanmış ve bu yük sayesinde de cam çubuk, kâğıt parçalarını çekebilmiştir.
» Sürtme sırasında elektriksel yüklerin ortaya çıkması, bu yüklerin en başından beri atomların yapısında bulunduğunu gösterir. Bu da atomların yapısında, atomdan çok daha küçük ve yüklü taneciklerin bulunduğu anlamına gelir. Atomun yapısında bulunan bu taneciklerin bir kısmı pozitif, bir kısmı negatif yüklüdür. Atomun yapısında bulunan pozitif yüklü taneciklere proton, negatif yüklü taneciklere de elektron adı verilir.
» Atom, merkezde çekirdek ve çekirdeğin çevresini saran elektronlardan oluşur. Çekirdekte protonlar ve nötronlar vardır. Protonlar pozitif elektrik yüklü, nötronlar ise yüksüzdür. Çekirdeğin çevresinde belirli yörüngelerde sabit hızla hareket eden elektronlar, negatif elektrik yüklüdür.
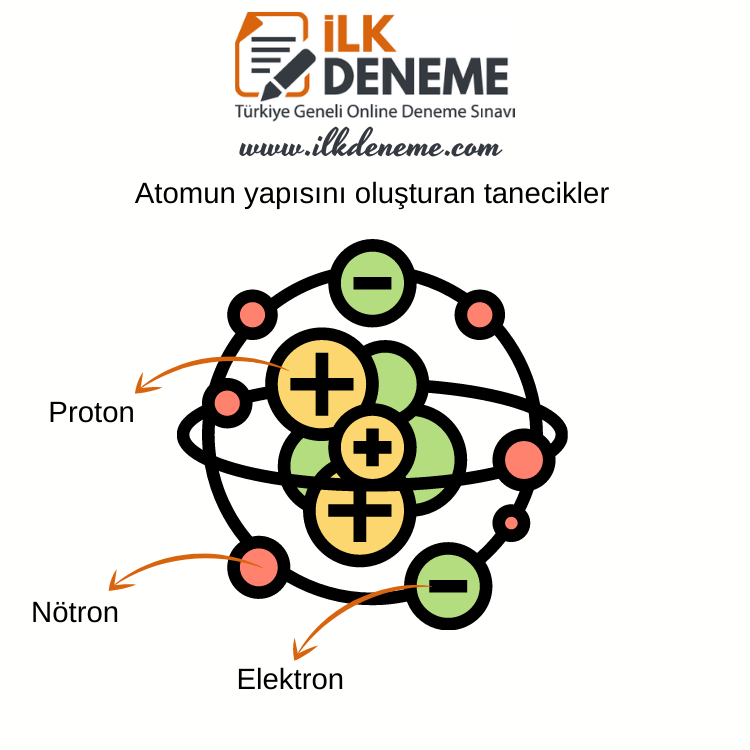
» Protonların ve elektronların elektrik yüklerinin güçleri birbirine eşittir. Buna göre, nötr bir atomda pozitif yüklü protonlar ile negatif yüklü elektronlar birbirini nötrlediği için “Atom yüksüzdür.” denir.
Örnek: Çekirdeğinde 8 proton, 8 nötron ve çekirdeğin çevresinde de 8 elektron bulunduran azot atomunda eşit sayıda pozitif ve negatif yük bulunduğu için nötr hâldedir.
» Atomda çekirdekte bulunan pozitif yüklü protonlar ile çekirdeğin çevresinde bulunan negatif yüklü elektronlar arasında bir çekim kuvveti vardır. Çekirdeğe daha yakın olan elektronlara uygulanan çekim kuvveti daha fazladır.
Atom Numarası
Bir atomun çekirdeğinde bulunan protonların sayısı, atomun kimliğini belirler ve bu sayıya atom numarası adı verilir.
Örnek: Karbon atomunun 6 protonu, azot atomunun 7 protonu, oksijen atomunun ise 8 protonu vardır. Bir elementin atom numarası elementin sembolünün sol altına yazılarak gösterilir. Örneğin atom numarası 13 olan ve Al sembolü ile gösterilen alüminyum elementinin atom numarası 13AI şeklinde gösterilir.
» Aynı elementin atomları için atom numarası aynı iken nötron sayısı ve elektron sayısı farklılık gösterebilir.
Örnek: Doğada bulunan karbon atomlarının tamamının çekirdeğinde 6 tane proton bulunurken % 98,9’unun nötron sayısı 6, % 1,1’inin nötron sayısı 7’dir.
Atom Kütlesi ve Atom Hacmi
Bir elektronun kütlesi, protonun ve nötronun kütlesiyle kıyaslandığında oldukça küçüktür. Yaklaşık olarak 1800 elektronun kütlesi, bir protonun kütlesine eşittir. Buna göre, bir atomun kütlesinin büyük çoğunluğunu çekirdekte bulunan proton ve nötronların kütlesinin oluşturduğu söylenebilir. Bir atomun hacminin büyük çoğunluğunu ise elektronlar oluşturur.
Enerji Katmanı
Elektronlar çekirdeğin çevresinde dairesel yörüngelerde hareket eder. Elektronun bulunma olasılığının fazla olduğu bu yörüngelere katman denir. Çekirdeğe yakın olan katmanda bulunan elektronlar, düşük enerjiye sahipken çekirdekten daha uzakta bulunan elektronlar, daha yüksek enerjiye sahiptir. Her bir katman, belirli sayıda elektron içerir. Birinci katmanda en fazla 2 elektron bulunabilirken, ikinci ve üçüncü katmanlarda en fazla 8 elektron bulunabilir. Bir katman tam olarak elektronla dolu değilken, bir sonraki katmanda elektron bulunamaz.
Örnek: Çekirdeğinde 14 proton ve 14 nötron bulunan silisyum atomuna ait modelde birinci katmanda 2 elektron, ikinci katmanda 8 elektron ve 3 katmanda da 4 elektron bulunur.
Atom Modelleri
MÖ 400’lü yıllarda Yunan filozofları ellerinde herhangi bir bilimsel malzeme olmadan, düşünme ve yorum yapma yeteneklerini kullanarak maddenin yapısını sorgulamış; evrendeki bütün maddelerin, çok küçük ve bölünemeyen parçacıklardan meydana geldiğine karar vermişlerdir. Democritus, maddeyi oluşturan bu parçacıklara atom adını vermiştir. Atom modelleri sıralanmıştır.
Dalton Atom Modeli
19. yüzyılda yaşamış İngiliz kimyacı ve fizikçi John Dalton, atom kavramı üzerine çalışmalar yapmış ve ilk bilimsel modeli tasarlamıştır. Dalton, bütün elementlerin atomlardan meydana geldiğini söyleyerek atomu içi dolu bir küre olarak tanımlamıştır.

» Ayrıca Dalton, bir elementin tüm atomlarının aynı olduğunu, farklı elementlerin de farklı atomlardan meydana geldiğini ve atomların daha küçük parçacıklara bölünemeyeceğini söylemiştir.
Thomson Atom Modeli
20. yüzyılın başlarında, atom üzerine çalışmalar yapan bilim insanı Thomson, yaptığı deneyler sonucunda atomun yapısında negatif yüklü tanecikler, elektronlar bulunduğunu keşfetti. Thomson bunun üzerine yeni bir atom modeli tasarladı ve tasarladığı atom modelini üzümlü keke benzetti.

» Thomson’un tasarladığı atom modeline göre negatif yüklü elektronlar, pozitif yüklü alan içerisinde dağınık olarak bulunuyordu. Thomson modelde kekin, pozitif yükleri; üzümlerin ise negatif yükleri temsil ettiğini söylemiştir.
Rutherford Atom Modeli
Ingiliz bilim adamı Ernest Rutherford, Thomson Atom Modeli’ni test etmek için bir deney düzeneği hazırladı. Rutherford, deneyde pozitif yüklü parçacıkları ince altın plaka üzerine göndererek parçacıkların hareketini gözlemlemeyi planlıyordu.

» Bu deney ile Rutherford, atomun küçük bir çekirdeğe sahip olduğunu ve bu çekirdeğin atomun kütlesinin büyük bir kısmını oluşturduğunu öne sürdü. Elektronlar negatif yüklü, atomlar da nötr olduğu için çekirdek, pozitif yüklü olmalıydı. 1918 yılında Rutherford, atom çekirdeğindeki pozitif yüklü bir parçacık olan protonu keşfetti. Proton ve elektron aynı miktarda elektrik yükü taşıyordu. Bir elektronun elektrik yükü, bir protonun elektrik yükünün etkisini yok ediyordu.
Bohr Atom Modeli
Danimarkalı fizikçi Niels Bohr, elektronun çekirdek etrafındaki hareketini inceledi. Bohr, elektronların çekirdeğe belirli uzaklıklardaki yörüngelerde hareket ettiğini söylemiştir.

» Bohr; elektronlara enerji verildiğinde elektronların yüksek enerjili yörüngelere atlayabildiğini, elektronlar enerji kaybettiğinde ise elektronların düşük enerjili yörüngelere atlayabildiğini öne sürmüştür. Bohr’a göre elektronlar, bu belirli yörüngeler dışında hareket edemez.
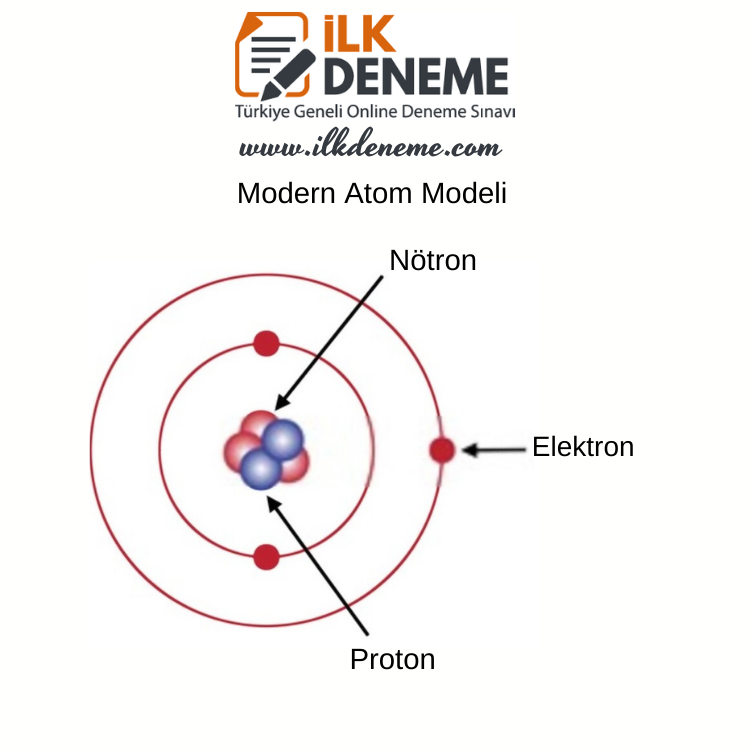
Modern Atom Modeli
Bohr’dan hemen sonra, bilim insanları belirli bir zamanda elektronların konumunun kesin olarak bilinmesinin mümkün olmadığını keşfetmişlerdir.
» Atom modeli, günümüzde Modern Atom Teorisi ile açıklanmaktadır. Modern Atom Teorisi’ne göre elektronun konumu kesin olarak belirlenemezken, bulunma olasılığının yüksek olduğu yerler belirlenebilir. Bilim insanları, elektronun bulunma olasılığının yüksek olduğu yerleri elektron bulutu olarak tanımlamıştır.
» Bilim insanlarının devam eden çalışmaları sayesinde, geçmişte öne sürülen bazı atom modelleri, zaman içerisinde geçerliliğini yitirmiştir. Bazı atom modellerinin ise eksiklikleri tamamlanarak yeni bir model öne sürülmüştür. Bu durum, modelleri öne süren bilim insanlarının hata yapmış olduğu anlamına gelmez. Bilimsel modeller, gözlenen olguları açıkladığı sürece ve açıkladığı ölçekte geçerlidir.
Nötronun Keşfi
Atomun kütlesini inceleyen bilim insanları, elektronlar çok küçük bir kütleye sahip olduğu için atomun kütlesinin, atomun protonlarının kütlesine yakın bir değer olmasını bekliyordu. Ancak sonuç bu şekilde değildi. Atomun kütlesi, protonlarının kütlesinin yaklaşık 2 katıydı. Bu farkı araştıran bilim insanları 1930 yılında çekirdekte protonla birlikte bulunan parçacık olan nötronu keşfettiler.